03/07/2025 1:52 am
Menú
LAS MEJORES COSAS QUE HACER EN MADRID
Menú
Descubre tu próxima lectura
Mujeres científicas
Celebramos el día de la mujer conociendo el método de edición génica; creado gracias a la colaboración de dos mujeres científicas
No hay mejor regalo para cualquier persona, sea mujer u hombre que la libertad. La libertad de educación, de actuación, de eliminar límites autoimpuestos o impuestos por terceros, de poder expresar cada opinión, de elegir a que dedicarse o a quién querer.
En un año en el que la ciencia es la única que nos devolverá la libertad de vivir, el mejor homenaje para todas nosotras, las mujeres, es conocer y agradecer descubrimientos como el de la Premio Nobel de Química 2020, Jennifer Doudna, que junto a otra mujer, Emmanuelle Charpentier desarrolló las tijeras genéticasCRISPR/Cas9, un método para la edición del genoma, que reescribe el código de la vida.
Índice
Toggle
EVA ZURDO – DIRECTORA GUÍA OCIO MADRID
Quizás a gran parte del mundo la edición del genoma le resulte aún muy lejana, pero gracias a estas dos mujeres, este método se está aplicando con éxito hoy en día en muchos campos. Obviamente el más beneficiado a corto plazo puede serel campo de la medicina, en la que ya se están generando tratamientos contra el cáncer y para eliminar disfunciones genéticas, como la gravísima anemia falciforme o la beta-talasemia. Pero, también se está aplicando en el sector agrariopara con el fin de eliminar plagas genéticas o en el sector ganadero, onde se busca entre otras cosas obtener carnes magras más sanas, con grasas saludables, introduciendo cambios en los genes de animales como las vacas o los cerdos.
Las posibilidades de este método son ilimitadas. Muchos científicos creen que los cerdos pueden servir de biorreactores para lo producción de valiosos medicamentos, como proteínas terapeúticas humanas que son demasiado complejas para sintetizarse desde cero y solo se pueden producir en células vivas. La primera de esta tipología de medicinas aprobada por la FDA es un anticoagulante llamado antitombrina, que es secretado en la leche de cabras modificadas genéticamente. Pero, se espera ir mucho allá, en las próximas décadas puede que hayamos modificado genéticamente a los cerdos para que sirvan de donantes de órganos humanos, dada su fácil reproducción y el tamaño similar de sus órganos.
Uno se da cuenta de la importancia de este hallazgo precisamente cuando se conoce todo lo que se puede hacer gracias a él. Y es que, CRISPR puede describirse como un par de tijeras moleculares de diseño cuya función especial es encontrar una secuencia específica de 20 letras del ADN y cortar ambas cadenas de la doble hélice. El uso más sencillo de CRISPR es emplearlo para cortar una secuencia específica de un gen y permitir a la célula reparar el daño reconectando las cadenas.
Los orígenes de CRISPR
El origen de la tecnología CRISPR parte del microbiólogo español Francisco Juan Martínez Mojica, cuando en 1989 realiza su tesis doctoral sobre un microorganismo aislado en las salinas de Santa Pola: ‘Haloferax mediterranei’. Mojica observó en el genoma de este organismo había una serie de secuencias genéticas que se repetían a intervalos regulares. Sorprendido, el investigador buscó en las bases de datos de información genómica y descubrió que en el mundo microbiano abundan las secuencias repetidas a intervalos regulares y que la verdadera naturaleza de estas secuencias repetidas, que él denominó CRISPR, resultaban ser un mecanismo de defensa de los microorganismos contra los virus, una especie de “vacuna genética”, que permite al cuerpo detectar a esos organismos si atacan de nuevo. Este hallazgo fue finalmente publicado en 2005 y, a partir de ese momento, numerosos grupos se lanzaron a desentrañar el funcionamiento exacto de CRISPR.
Reescribiendo el código de la vida
En 2008 Jennifer Doudna y su equipo descubren cómo al enfrentamos a una infección, las bacterias sustraen trocitos de ADN del genoma del fago y los integran con precisión entre las repeticiones de CRISPR para que el sistema defensivo pueda atacar el material genético del virus. Les faltaba determinar cómo un trozo de ARN podía aparearse con el ADN correspondiente del fago y causar su destrucción. Pronto lo hicieron: descubrieron la enzima llamada Cas1, una auténtica grieta en la creación, ya que, esta enzima tiene la capacidad de cortar el ADN de un modo que sirve para insertar nuevos trozos de ADN del fago en la secuencia de CRISPR durante la fase de formación de la memoria inmune. Habían descubierto estas enzimas de corte de ADN como herramienta diagnóstica para detectar moléculas de ARN indicadoras de la presencia de virus humanos. Las proteínas Cas empezaron a comercializarse.
En pararelo, la doctora Emmanuelle Charpentier había encontrado por azar una segunda molécula de ARN que era necesaria en algunos casos para la producción de los ARN de CRISPR. Este descubrimiento sugería que la evolución había generado una navaja suiza virtual para luchar contra los virus. Enmanuelle estaba muy interesada en determinar la manera en que el sistema CRISPR de Tipo II de Streptococcus pyoenes, la bacteria infecciosa que estaba estudiando (conocida como “ come carne”), cortaba el ADN viral. El estudio era relevante porque un gran número de enfermedades humanas están unidas a esta bacteria (escarlatina, faringitis estreptocócica, etc).
Finalmente, Enmanuelle y Doudna se unieron para averiguar cuál era el papel preciso de Cas9. Empezaron a trabajar con esta bacteria in vitro (“ en el vidrio”), no “ in vivo” (en vida). El trabajo conjunto realizado por los equipos de ambas científicas parecía mostrar que Cas9 era incapaz de cortar el ADN, así que decidieron realizar otros experimentos, en los que no solo incluyeron el ARN de CRISPR, sino también un segundo tipo de ARN llamado ARNtracr que era necesario para la producción de los ARN de CRISPR en S.pyoenes. El resultado fue espectacular: cualquier ADN que contuviera una secuencia de veinte letras perfectamente coincidentes con la molécula de ARN de CRISPR se cortaba limpiamente. Esta doble hélice de ARN-ADN podría ser la clave de la especificidad en la actividad de corte de Cas9. Los componentes cruciales para cortar el ADN era la enzima Cas9, el ARN de CRISPR y el ARNtracr. Advirtieron que las bacterias podían programar Cas9 para cortar en posiciones virales específicas , pero querían saber si los investigadores podrían programar Cas9 para cortar las secuencias de ADN deseadas. Empezaron probando un gen de medusa llamado “proteína verde fluorescente” , llamado GFP. El experimento demostró que el ADN de GFP se había cortado en todos los lugares esperados, cada molécula de ARN había funcionado como preveían, seleccionando el punto exacto del ADN de medusa que querían cortar y emparejándose con Cas9 para escindirlo en esa localización concreta.
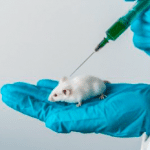
Tanto los académicos como los médicos lo recibieron como el santo grial de la manipulación génica: un modo rápido y preciso de reparar defectos en el código genético. Si los científicos podían introducir CRISPR de modo seguro y eficiente en el cuerpo humano, de manera que la edición génica funcionara igual de bien en los pacientes que en las células cultivadas en el laboratorio, entonces las posibilidades para transformar la medicina serían ilimitadas. Así,comenzaron sus primeras pruebas de edición génica con unas células embrionarias de riñón llamada HEK 293. Generadas inicialmente en 1973 a partir de células de riñón provenientes de un feto abortado, las HEK 293 se habían hecho populares entre los biólogos celulares porque eran sencillas de cultivar en el laboratorio y por la facilidad con las que aceptaban ADN extraño.
El ayudante de Doudna, Martín, observó que las células de riñón estaban produciendo ingentes cantidades de ARN guía. El trasplante de CRISPR de las células bacterianas a las células humanas había funcionado como esperaba: ¿Podía ser que CRISPR estuviese editando el ADN humano? El resultado no daba lugar a dudas: el gen se había editado exactamente en el lugar que coincidía con la secuencia de ARN de CRISPR. Con tan sólo unos pocos pasos sencillos y rutinarios, Martín y Doudna habían seleccionado una secuencia arbitraria de ADN entre los 3.200 millones de letras del genoma humano, diseñando una versión de CRISPR para editarla y observado como la diminuta maquinaria molecular reprogramada actuaba, todo eso, en células humanas vivas. Se confirmaba, habían encontrado el método para reescribir el código de la vida.
Poco tiempo después, Rudolf Jaenisch del MIT , que en 1989 había recibido el Premio Nobel por desarrollar cambios genéticos en ratones, anunció la generación de ratones editados genéticamente usando CRISPR: microinyección de los componentes de CRISPR directamente en embriones de una célula, seguida de la implantación de los embriones genéticamente editados en el útero de la hembra. Mientras que la técnica original que empleaba células madres embrionarias sólo se podía utilizar en ratones, daba la sensación de que CRISPR podía inyectarse en las células germinales de cualquier especie (óvulos y espermatozoides) o en embriones , y los cambios genéticos resultantes se copiarían fielmente en todas las células transmitiéndose a las siguientes generaciones.
De hecho, otros científicos están usando herramientas de edición génica para influir en la reproducción, de modo que las gallinas sólo tengan hembras por ejemplo (los pollos maco se suelen sacrificar un día después de la eclosión), para que los peces de piscifactoría sean estériles (evitar contaminación bacteria) o para que en el ganado solo nazcan machos.
“Quién sabe si hasta un día puede que tengamos mamuts lanudos, lagartos alados y unicornios” afirma Jennifer Doudna, en su libro “Una grieta en la creación” en el que explica el paso a paso de su hallazgo. Y es que, ya se están haciendo experimentos con CRISPR para convertir trozo a trozo el genoma de especies extintas y conseguir devolverlas a la vida. Se está experimentando por ejemplo con ciertas aves , con un ejemplar de cabra ibérica extinta o con el mamut lanado (este último partiendo del genoma del elefante). Además, hoy en día los ordenadores facilitan la edición génica más que nunca: usando algoritmos avanzados ,varios paquetes de software ofrecen a los investigadores un método automatizado directo para construir la mejor versión de CRISPR necesaria para editar un gen concreto.
Regulación de los OMG
Pese a todos estos avances, a no ser que la opinión de la actitud pública cambie respecto a los elementos mejorados genéticamente, nosotros como sociedad no podremos beneficiarnos de todo el potencial de CRISPR. Basta de ejemplo el primer salmón modificado genéticamente aprobado para el consumo humano en EEUU (Aqadvantage), que solo pudo llegar al mercado tras veinte años de batalla con los reguladores de la FDA y un coste de más de 80 millones para su creador. En este salmón se ha insertado un gen adicional de la hormona del crecimiento para que el pez llegue a su peso de mercado en la mitad de tiempo que un salmón tradicional, pero sin cambiar su contenido nutricional ni incrementar los riesgos. Este hecho disminuirá la cantidad de salmón importado y aportará al mercado pescado con una huella de carbono veinticinco veces menor que el salmón tradicional.
Además, es necesario aclarar a qué se refieren los gobiernos de los distintos países y los grupos de presión cuando utilizan el término organismo modificado genéticamente, ya que, éste es el nombre que recibe cualquier organismo cuyo material genético ha sido transformado de una manera ajena a los métodos naturales de multiplicación mediante modificación genética. Sin embargo, no deben confundirse con los transgénicos porque todos los transgénicos son OGM, pero no todos los OGM son transgénicos.
Los transgénicos son los organismos genéticamente modificados a los que se les han añadido genes de otra especie. Los OGM a los que simplemente se les inhibe o potencia la expresión de uno de sus genes son OGM a secas (no transgénicos). Así, en 2015 el 92% de todos los cultivo de maíz y el 94% de soja y algodón estaban modificados genéticamente, motivo por el que la OMG se ha sometido a una de las regulaciones más intensas que hayan tenido ningún producto de consumo humano en el seguro, por lo que, existe un amplio consenso sobre su seguridad. Debido a que, el proceso de autorización es largo y caro, muchas empresas han quedado fuera del campo de los OMG por el coste prohibitivo. Afortunadamente, el USDA ha comenzado a informar discretamente a las empresas de que estos nuevos cultivos editados genéticamente no requerirá de su aprobación, aunque aún requerirán de la FDA.